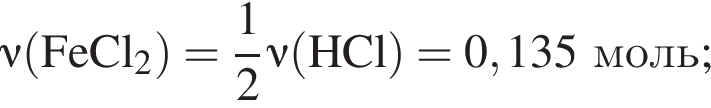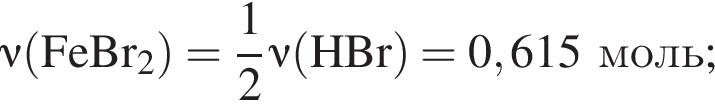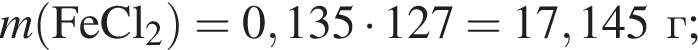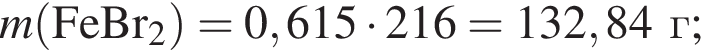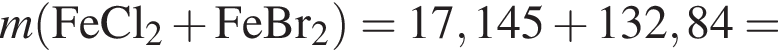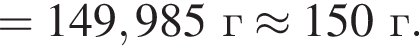Заряд ядра химического элемента +31. Его относительная атомная масса равна:
Названия аллотропных модификаций одного и того же химического элемента представлены в ряду:
Оксид фосфора(V) проявляет кислотные свойства, реагируя с веществами:
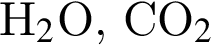
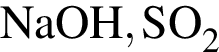
Укажите НЕПРАВИЛЬНОЕ утверждение относительно водорода:
Реагируют с концентрированной серной кислотой, но НЕ реагируют с разбавленной серной кислотой оба вещества пары:
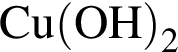
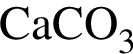
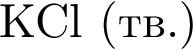
Очистить угарный газ от углекислого можно с помощью водных растворов веществ:
а — 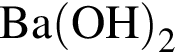
б — 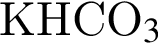
в — 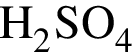
г — 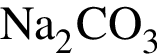
Сумма коэффициентов перед веществами молекулярного строения в уравнении реакции, протекающей по схеме 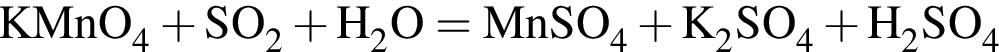 , равна:
, равна:
Модель молекулы этанола изображена на рисунке:
Укажите схему реакции замещения согласно классификации органических реакций:
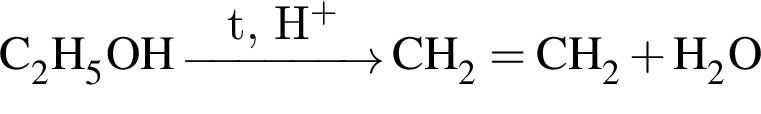
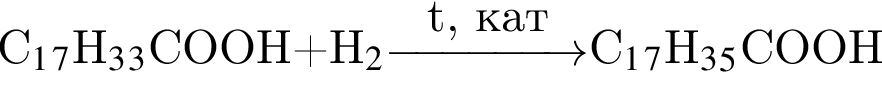

Гомологи образуются при гидрировании избытком водорода углеводородов пары:
Органическое вещество ![]() полученное по схеме
полученное по схеме  может реагировать в указанных условиях c:
может реагировать в указанных условиях c:
Укажите вещество, из которого в указанных условиях можно получить этаналь:
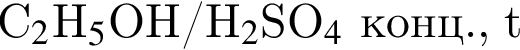
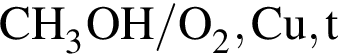
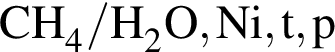
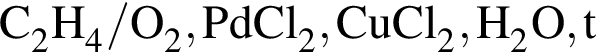
В сосуде протекает обратимая реакция:

Скорость прямой реакции уменьшится при:
Выберите утверждения, верно характеризующие этин:
а) в молекуле две ![]() -связи;
-связи;
б) молекула имеет угловое строение;
в) обесцвечивает бромную воду;
г) при 20 °C представляет собой хорошо растворимую в воде жидкость.
Белый осадок образуется при смешивании растворов веществ пары:
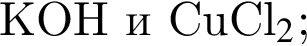
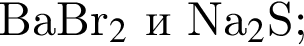
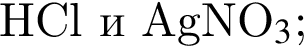
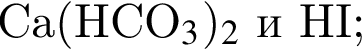
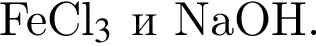
В пищевой промышленности в качестве консерванта широко используется:
К раствору медного купороса массой 24 г с массовой долей сульфата меди(II) 8% добавили некоторое количество насыщенного раствора сульфида натрия. Растворимость сульфида натрия в условиях эксперимента составляла 25 г на 100 г воды. После отделения осадка оказалось, что концентрация (моль/дм3) ионов ![]() в растворе в шесть раз больше, чем
в растворе в шесть раз больше, чем ![]() Определите массу (г) насыщенного раствора сульфида натрия, использованного в описанном эксперименте.
Определите массу (г) насыщенного раствора сульфида натрия, использованного в описанном эксперименте.
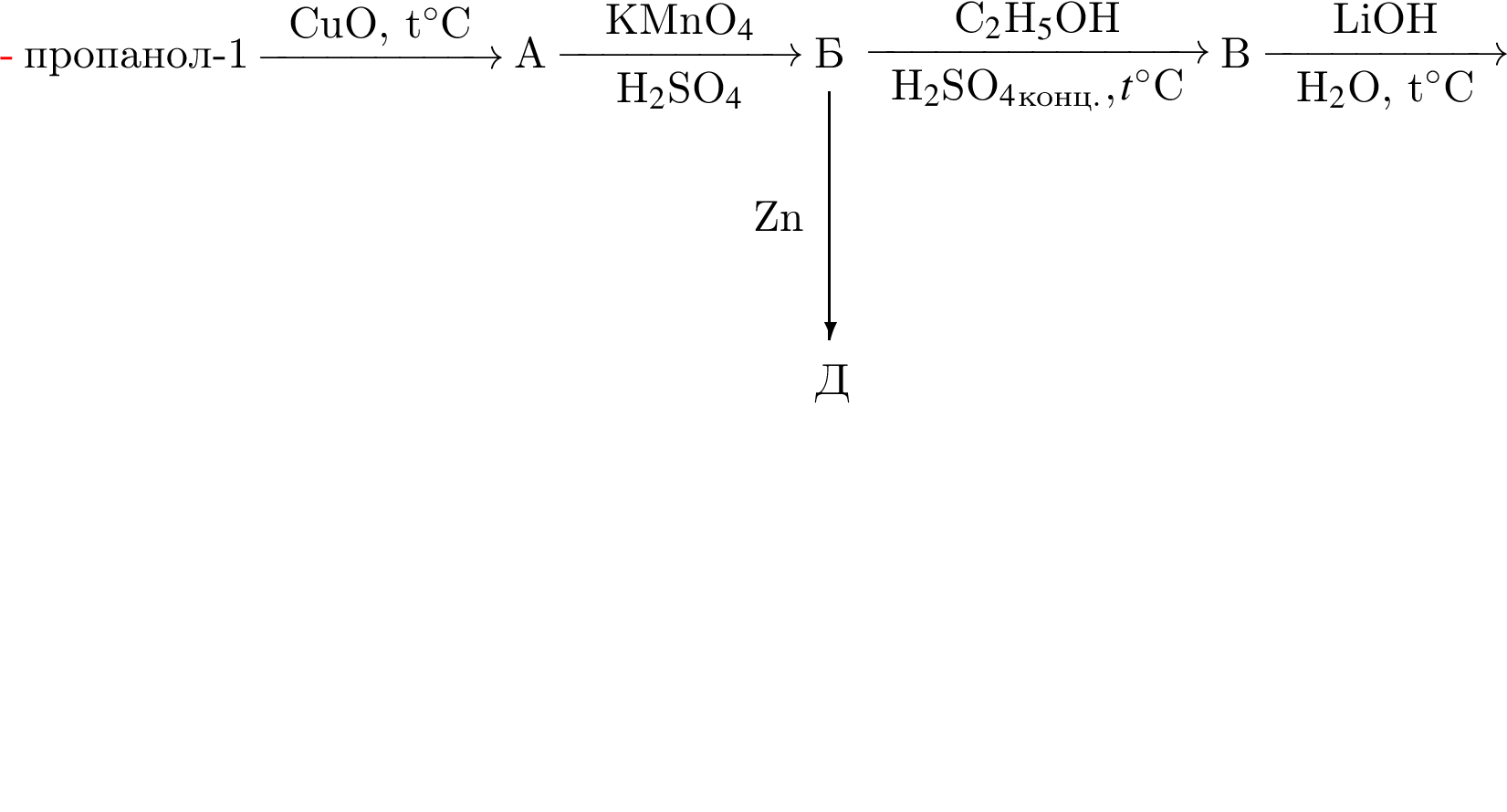
Определите молярную массу (г/моль) органического вещества Д немолекулярного строения, образующегося в результате следующих превращений:
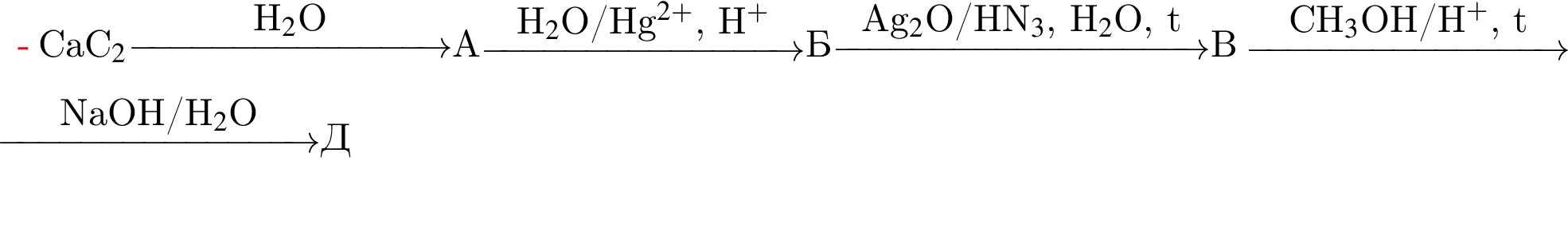
Для получения веществ по указанной схеме превращений
![]() →
→ ![]() →
→ 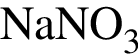 →
→ ![]() →
→ ![]()
выберите реагенты из предложенных:
1 — 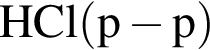
2 — ![]()
3 — 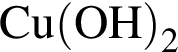
4 — 
5 — 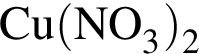
6 — ![]()
Ответ запишите цифрами в порядке осуществления превращений, например: 2443. Помните, что один реагент может использоваться несколько раз, а другой — не использоваться вообще.
Дан перечень неорганических веществ: аммиачная селитра, графит, гидроксид магния, гидросульфит калия, кремнезем, оксид фосфора(V), фтор, хлорид меди(II). Укажите число высших оксидов, нерастворимых оснований, солей и простых веществ соответственно.
Ответ запишите цифрами, соблюдая полученную последовательность, например: 1322.
Простое газообразное вещество А желто-зеленого цвета с резким запахом реагирует с металлом Б, в результате чего получается вещество В. Газ А имеет плотность (н. у.), равную 3,17г/дм3. Химический элемент, образующий Б, в соединениях имеет валентность II, а избыток его катионов обуславливает жесткость воды. При действии на В массой 33,84г избытка концентрированной серной кислоты с выходом 82% выделяется бесцветный, хорошо растворимый в воде газ Г объемом (н. у.) 11,2дм3. Определите сумму молярных масс (г/моль) веществ А и В.
Найдите сумму молярных масс (г/моль) органических веществ ![]() и
и ![]() (вещество
(вещество ![]() имеет немолекулярное строение) в схеме превращений
имеет немолекулярное строение) в схеме превращений
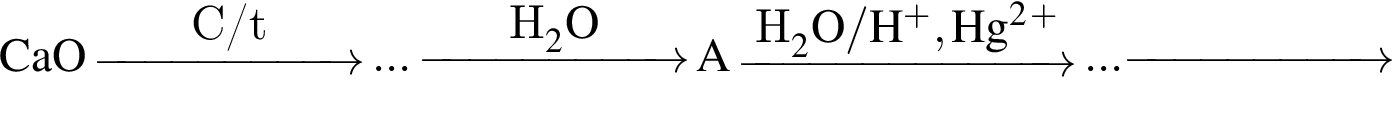

В четырех пронумерованных пробирках находятся растворы неорганических веществ. О них известно следующее:
— вещества из пробирок 2 и 3 нейтрализуют друг друга, способны растворять цинк, его оксид и гидроксид;
— вещества из пробирок 3 и 4 реагируют между собой с образованием осадка, способного растворяться как в кислотах, так и в щелочах;
— при электролизе расплава вещества из пробирки 1 выделяется газ (н. у.) зеленовато-желтого цвета, имеющий характерный запах.
Установите соответствие между содержимым пробирки и ее номером.
А) гидроксид калия
Б) сульфат алюминия
В) азотная кислота
Г) хлорид натрия
1
2
3
4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б1В3Г4.
В результате полного восстановления оксида железа(III) углеродом была получена смесь угарного и углекислого газов количеством 1,2 моль и массой 35,7 г. Рассчитайте массу (г) образовавшегося при этом железа.
Установите соответствие между исходными веществами и суммой коэффициентов в полном ионном уравнении реакции. Все электролиты взяты в виде разбавленных водных растворов.
А) ![]() и
и ![]()
Б) ![]() и
и 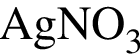
В) ![]() и
и 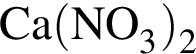
Г) ![]() и
и 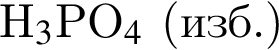
1 — 6
2 — 8
3 — 12
4 — 14
5 — 17
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4ВЗГ2.
При электролизе воды массой 130 кг получили водород объемом 144 м3 (н. у.). Определите выход (%) продукта реакции.
Для получения веществ по схеме превращений:
![]() →
→![]() →
→ 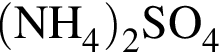 →
→ 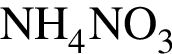 →
→ ![]()
выберите варианты из предложенных:
1 - 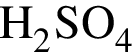
2 - 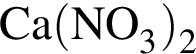
3 - ![]()
4 - 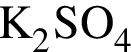
5 - ![]()
6 - 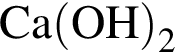
Ответ запишите цифрами в порядке следования превращений, например, 5314.
Определите сумму молярных масс (г/моль) органических веществ молекулярного строения А и немолекулярного строения Д и Г, полученных в результате превращений:
Выберите утверждения, верно характеризующие аммиак:
| 1 | вступает в реакцию соединения с уксусной кислотой |
| 2 | является сырьем для производства аммиачной селитры |
| 3 | образуется при взаимодействии кислот с солями аммония |
| 4 | молекула содержит неподеленную электронную пару |
| 5 | водородный показатель (pH) водного раствора равен 1 |
| 6 | в молекуле имеется водород в степени окисления −1 |
Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 654
Выберите утверждения, верно характеризующие глюкозу.
| 1 | является изомером вещества |
| 2 | относится к сложным эфирам |
| 3 | имеет молярную массу большую, чем молярная масса фруктозы |
| 4 | при восстановлении водородом образует вещество 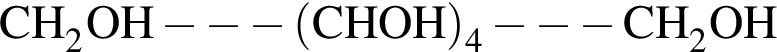 |
| 5 | продуктами полного окисления являются |
| 6 | в линейной форме молекулы содержится одна карбоксильная и четыре гидроксильные группы |
Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 123.
К 50 дм3 смеси, состоящей из пропана и аммиака, добавили 15 дм3 хлороводорода. После приведения новой газовой смеси к первоначальным условиям ее относительная плотность по воздуху составила 0,935. Укажите массовую долю (%) пропана в исходной смеси. (Все объемы измеряли при t = 20 °C, Р = 105 Па.)
Установите соответствие между формулой вещества и типом химической связи в нем.
А) ![]()
Б) ![]()
В) ![]()
Г) ![]()
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б2В3Г4.
Выберите утверждения, верно характеризующие минеральные удобрения:
| 1 | питательная ценность фосфорного удобрения определяется массовой долей в нем |
| 2 | аммофоска является комплексным удобрением |
| 3 | основной компонент поташа — это 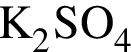 |
| 4 | массовая доля азота в нитрате аммония больше, чем массовая доля азота в нитрате калия |
| 5 | карбамид относится к калийным удобрениям |
| 6 | 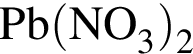 относится к селитрам относится к селитрам |
Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 456
В таблице указаны реактивы, с помощью которых можно определить ионы: 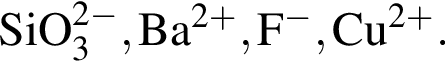 Установите соответствие между формулой реактива и числом выявленных ионов. (Все реакции протекают при 20 °C в разбавленных водных растворах, гидролиз не учитывать).
Установите соответствие между формулой реактива и числом выявленных ионов. (Все реакции протекают при 20 °C в разбавленных водных растворах, гидролиз не учитывать).
А) 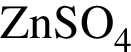
Б) ![]()
В) 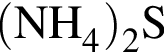
Г) 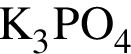
1) 1
2) 2
3) 3
4) 4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А3Б4В4Г2. Помните, что некоторые данные правого столбца могут использоваться несколько раз или не использоваться вообще.
Дано термохимическое уравнение сгорания метана:
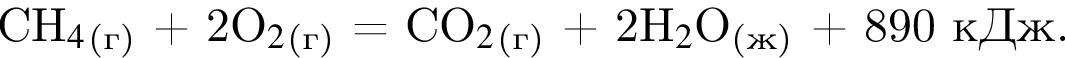
Рассчитайте, какое количество теплоты (кДж) выделится, если в реакцию вступит 40 г смеси метана и кислорода, взятых в объемном соотношении 1:2 соответственно.
Для получения стекла состава 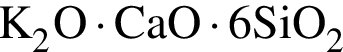 массой 612 г были использованы поташ, мел и песок. Найдите массу израсходованного поташа, в котором массовая доля карбоната калия 80%. Примеси в других компонентах не учитывать
массой 612 г были использованы поташ, мел и песок. Найдите массу израсходованного поташа, в котором массовая доля карбоната калия 80%. Примеси в других компонентах не учитывать
Расположите водные растворы веществ в порядке убывания их pH:
1) 0,1 моль/дм3 ![]()
2) 0,1 моль/дм3 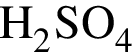
3) 0,1 моль/дм3 ![]()
4) 0,1 моль/дм3 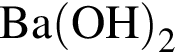
Ответ запишите в виде последовательности цифр, например: 1234
Смесь хлороводорода и бромоводорода имеют относительную плотность по неону 3,65. Данную смесь объемом (н. у.) 33,6 дм3 растворили в 430 см3 воды. Затем в раствор опустили железную гайку массой 70,04 г. Вычислите суммарную массу (г) солей в растворе, полученном после полного завершения реакции.

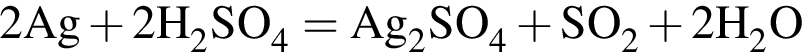
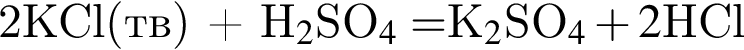 ↑
↑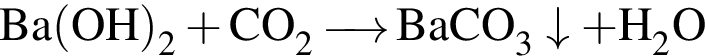 .
.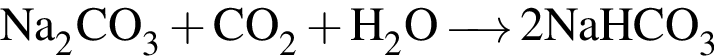 .
.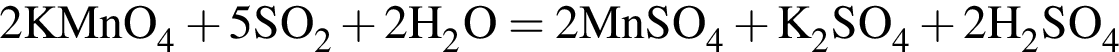
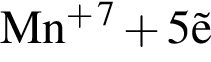 →
→ 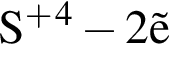 →
→ 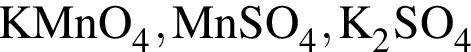 - вещества ионного строения,
- вещества ионного строения,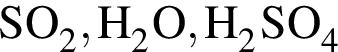 - вещества молекулярного строения.
- вещества молекулярного строения.
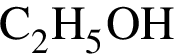 . Остальные модели соответствуют:
. Остальные модели соответствуют: 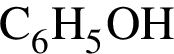 — фенол. Будучи слабой кислотой, реагирует с растворами щелочей.
— фенол. Будучи слабой кислотой, реагирует с растворами щелочей.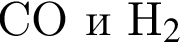 в соотношении 1 : 3.
в соотношении 1 : 3.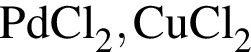 при повышенных температурах.
при повышенных температурах.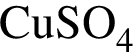 содержится чистого вещества 24*0.08=1.92 г
содержится чистого вещества 24*0.08=1.92 г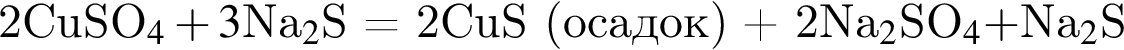
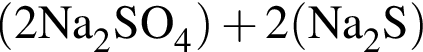 = 6 моль,
= 6 моль,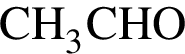 .
.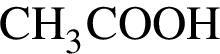 .
.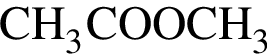 .
.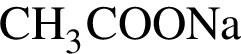 c молярной массой = 82 г/моль.
c молярной массой = 82 г/моль.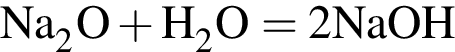
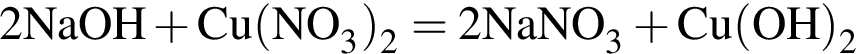
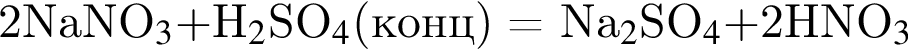
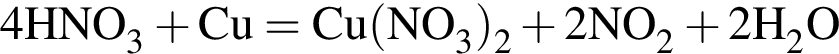
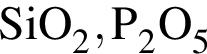 ;
;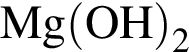 ;
;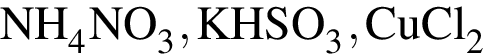 ;
;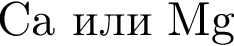 , т. к. они оба в соединениях имеют валентность II, а избыток их катионов обуславливает жесткость воды.
, т. к. они оба в соединениях имеют валентность II, а избыток их катионов обуславливает жесткость воды. 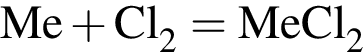 , где
, где 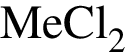 - вещество В.
- вещество В.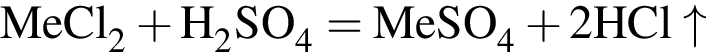 , где
, где 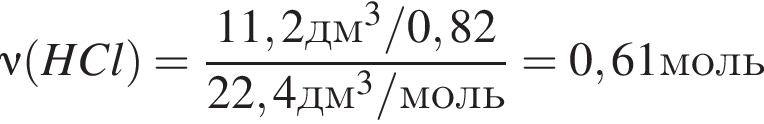
 Откуда
Откуда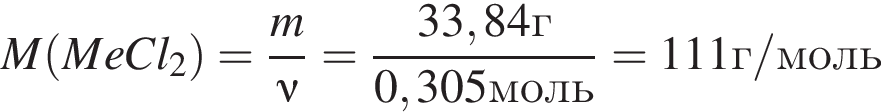

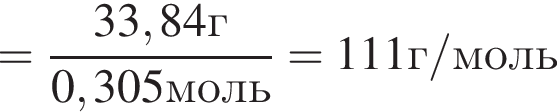

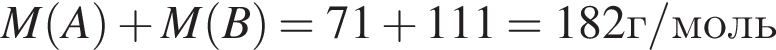
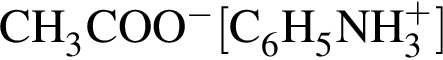 М=153 г/моль
М=153 г/моль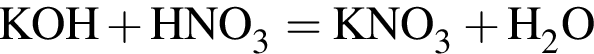
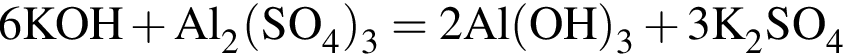
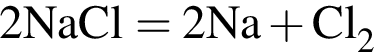 (зеленовато-жёлтый газ)
(зеленовато-жёлтый газ)

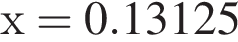 и
и 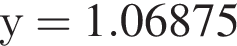
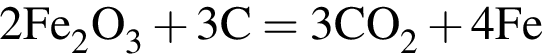
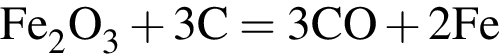
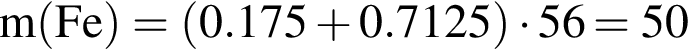 г
г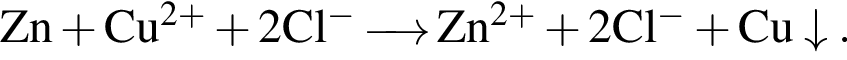 Сумма коэффициентов — 8.
Сумма коэффициентов — 8.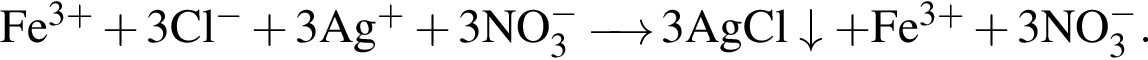 Сумма коэффициентов — 17.
Сумма коэффициентов — 17.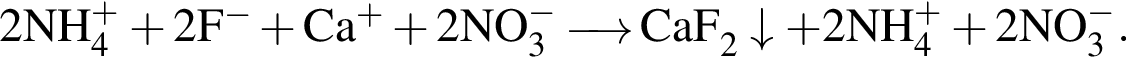 Сумма коэффициентов — 12.
Сумма коэффициентов — 12. Сумма коэффициентов — 6.
Сумма коэффициентов — 6.
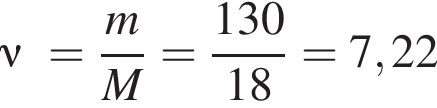 кмоль
кмоль
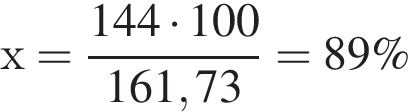
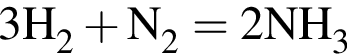
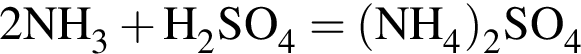
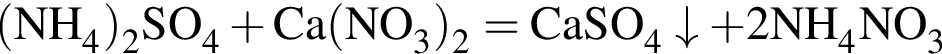
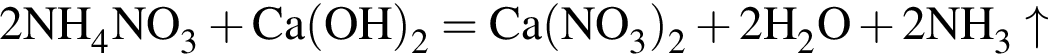
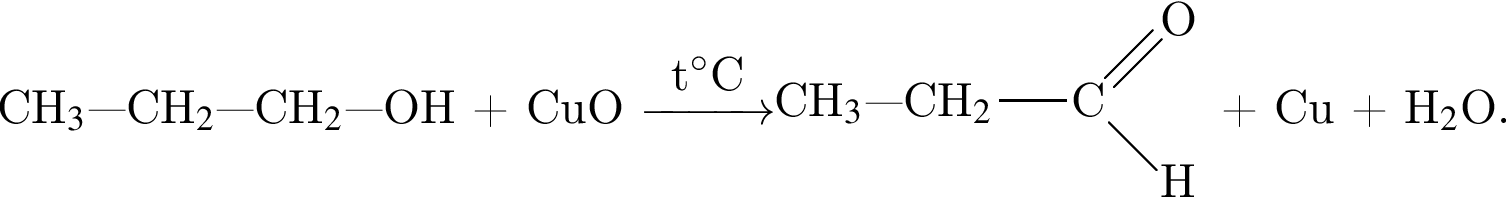


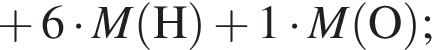

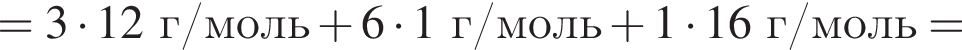
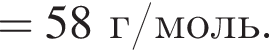
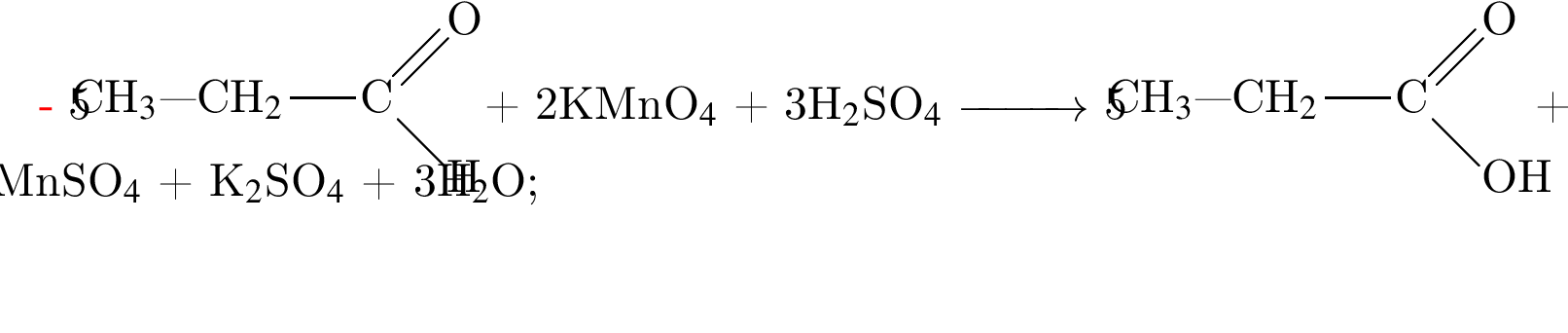
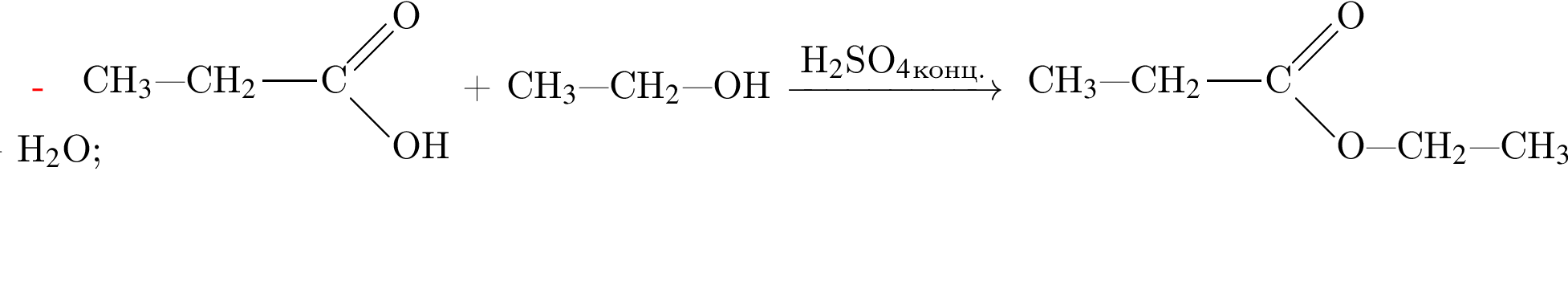
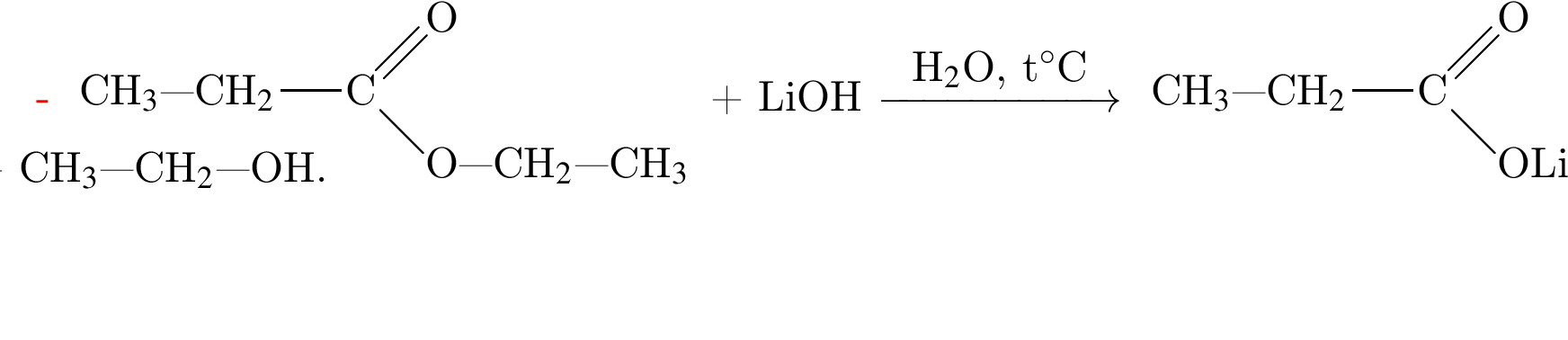
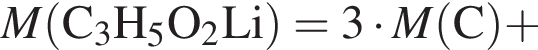
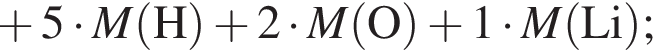
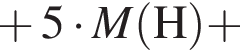
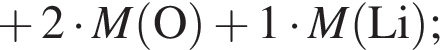

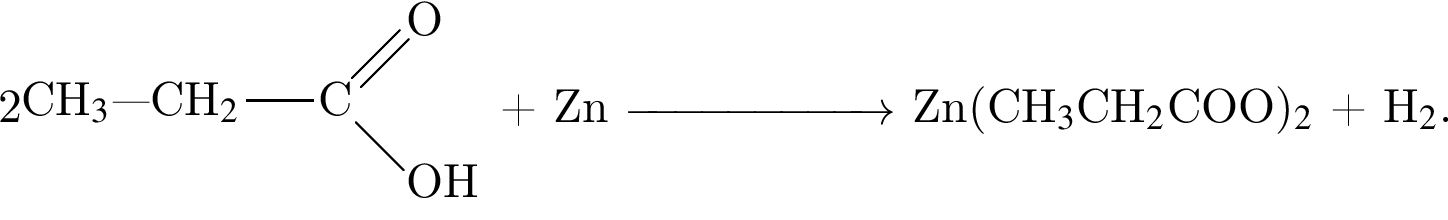

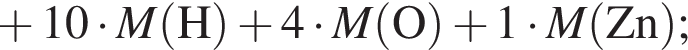
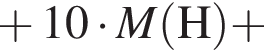



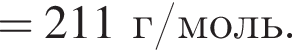
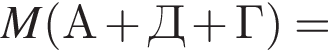
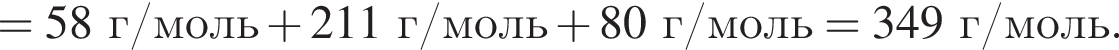
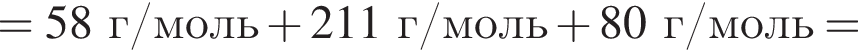
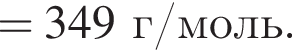
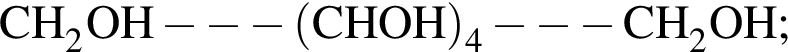
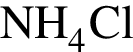
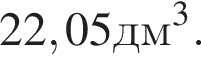 Следовательно, в исходной смеси объем аммиака = 21,3 + 15 = 37,05
Следовательно, в исходной смеси объем аммиака = 21,3 + 15 = 37,05 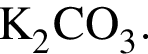
 Количество вещества кислорода равно
Количество вещества кислорода равно  Тогда:
Тогда: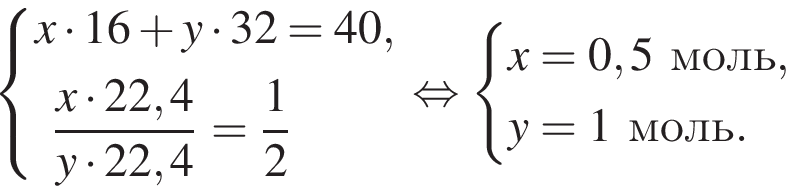
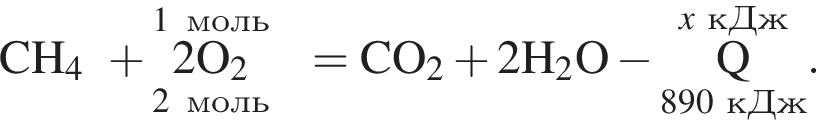
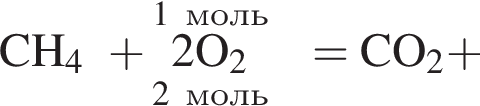
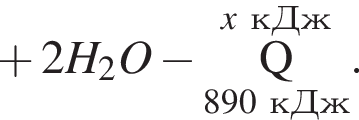
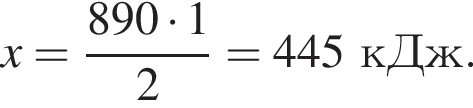

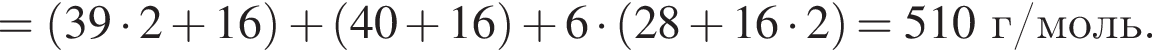

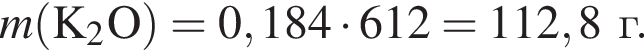
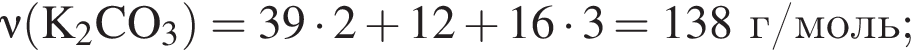
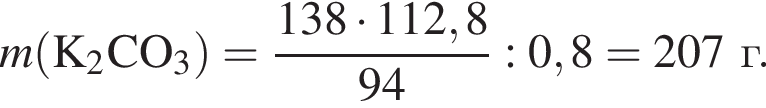
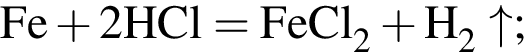
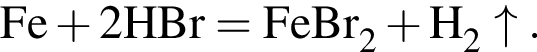
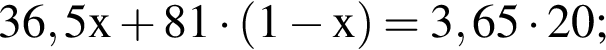
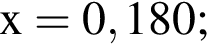
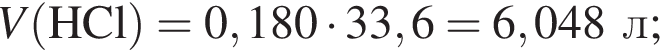
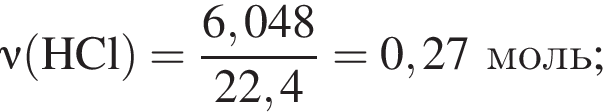

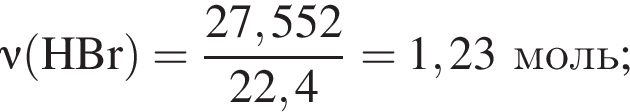
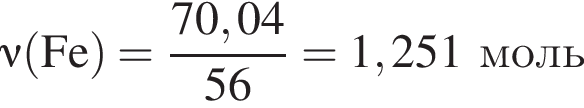
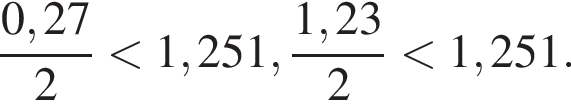 Тогда:
Тогда: